This is the Japanese translation of this site.
ジョナサン・マクラッチー
2023/6/26 6:44
前回の記事で、YouTuberのデイブ・ファリーナ (通称「デイブ教授」) がマイケル・ベーエ博士の3冊の著書を論評した動画について、4回にわたって回答するシリーズを始めました。ここでは、細菌の鞭毛についてのファリーナ氏のコメントに注目することにします。
鞭毛に関連して、この動画ではベーエの「機械関連の用語の不誠実な使い方」に苦言を呈しています。それには、「船外モーター」、「ドライブシャフト」、「自在継手」、「ブッシング」、「クラッチとブレーキシステム」といったフレーズが含まれています。実際には、このような用語は科学文献で広く使われています。ベーエに限ったことではありません。それどころか、鞭毛に関する文献には、「モーター」1、「ドライブシャフト」2、「自在継手」3、「ブッシング」4、「クラッチ」5のような用語が溢れています。「マシン」という言葉自体も広く流布しています6。ファリーナは、鞭毛の研究コミュニティ全体をも不誠実だと告発するつもりなのでしょうか?
細菌の鞭毛の起源に関する流用のシナリオ
動画によれば、「滑らかに回転するのではなく、単に痙攣する鞭毛も運動を引き起こすので、選択される可能性がある」 とのことです。しかし、痙攣運動 (湿った表面上のバクテリアルトランスロケーションの一形態) を可能にするIV型線毛は、鞭毛とは大きく異なっています。痙攣運動はIV型線毛の伸長、付着、収縮によって起き、鉤縄に似た方法で機能します。一方、鞭毛は細胞膜を横切るプロトン駆動力によって回転します。線毛と鞭毛の組み立て機構もまったく異なっています。
この動画は、ベーエがサルモネラ菌や大腸菌に見られるモデル系よりも単純な別の鞭毛システムの存在を認識できていないと不平を述べています。しかし、代替系において、他の系に不可欠な特定の構成要素が欠如していることは、同じ成果を得るための代替機構が前者に欠如していることを意味しません。還元不能な複雑性の最も強固な概念は、その複雑性を、1つでも取り除かれるとシステム全体が事実上その役割を果たせなくなるような、複数の副次的機能が寄与するシステムの性質として理解するというものです。個々の副次的機能は、原理的には複数のタンパク質構成要素によって実行されうることに注意してください。同様に、単一のタンパク質構成要素がそれらの副次的機能のうちの1つ以上を実行することもありえます。さらに、それぞれの副次的機能を実行する特定の構成要素の同一性は、生物によって異なるかもしれません。したがって、還元不能なほど複雑なシステムで重要なのは、構造部分の同一性ではなく、より高いレベルの目的を実現するために実行される必要のある本質的な機能なのです。
さらに、鞭毛タンパク質の相同性を指摘しても、還元不能な複雑性の論議は損なわれません。というのも、タンパク質を流用して鞭毛システムを産み出すことには、新しいシステムを実現するために、複数の同時並行的変化が要求されるからです。例えば、鞭毛特有のタンパク質は、鞭毛システムに組み入れられるまでは選択的優位性をもたらさなかったでしょう。しかし、これらの鞭毛特有のタンパク質が生じる前に、他のシステムで役割を果たしている必要なタンパク質が鞭毛システムに組み入れられるようになることはないでしょう。これは、相補的なタンパク質-タンパク質結合界面や、タンパク質が適切な順序で組み合わされることを保証するように構成された組み立てシステムの必要性とはまったく別の話です。
鞭毛の復活
『Evolution News』の2016年の記事で、ベーエはこのように質問しています。
なぜ (ケネス・ミラーは) 適切な細菌種を選び、その鞭毛の遺伝子をノックアウトし、その細菌を選択圧 (例えば運動性) の下に置き、研究室で実験的に鞭毛 (あるいは同等の複雑なシステム) を産み出さないのでしょうか?(結局のところ、鞭毛の遺伝子は自然選択による迅速な再デザインが容易だとミラーが主張している数百個もなく、30~40個しかありません)。彼がそうしたなら、私の主張は完全に反証されるでしょう。しかし、彼は成功の見込みを著しく誇張しているため、それを試そうともしません。
ファリーナの動画のコメントが下記です。
面白いことに、[ベーエは] この精密な実験が前年に行われたという事実に気づいていません。これがその論文です。遺伝子の欠失によって、鞭毛をもたない細菌が2株産み出されました。そして、コロニー内の栄養分を枯渇させることによって、運動性への選択圧を導入しました。96時間以内に、他の役割を果たす遺伝子の2つの連続した点突然変異が関与する経路により、両方の株が鞭毛運動を再生させました。
しかし、ファリーナが引用した論文7では、このようなことはまったく行われていません。この動画では初めてのことではありませんが、彼が本当に論文を読んだのか疑問です。研究者たちが除去したのは、シュードモナス・フルオレッセンスの鞭毛のマスタースイッチタンパク質であるFleQだけです。その細菌細胞をペトリ皿の上で数日間培養すると、鞭毛を成長させる能力を再獲得しました。この鞭毛の再活性化の遺伝的基盤は、FleQの構造的によく似たホモログである別のマスタースイッチタンパク質NtrC (窒素代謝に関わる遺伝子をオンにする役目がある) が、通常FleQによって結合するプロモーターに交差結合する能力をすでにある程度持っていたことです。制御因子が壊れた結果、過剰に生産されたNtrCは、鞭毛合成を促進できるようになりました。この突然変異の結果、細菌細胞は窒素代謝遺伝子を制御する能力を失いました。『The Scientist』の記事でこの研究について説明されています。
しかし、再進化した鞭毛によって、細菌はペトリ皿の最も遠い範囲にある食料源に接近できるようになった一方で、その能力には代償が伴った。「泳ぎが得意になったバクテリアは、窒素の調節が苦手になってしまったのです」とジョンソンは言う。しかし、「そうしなければ死んでしまうので、その代償を払うに値するほど利点が大きいこともあります」と彼女は付け加えた。
したがって、ファリーナの動画の主張とは逆に、この論文は細菌の鞭毛の新規の進化的起源を全く記述しておらず、それとはかけ離れています。事実、ベーエはすでにこの論文をこちらで取り上げています。
待ち時間問題
2004年に、マイケル・ベーエとデイヴィッド・スノークは『Protein Science』にある論文を発表しました8。この論文について、ファリーナは3つの不平を述べています。最初の不平は、「ベーエとスノークは、標的配列がまさしく、全体的に現実的な集団サイズと時間枠で、またどちらかといえば、現実世界の集団と比べるとかなり小さくても、実際に進化することを発見しました。この論文は文字どおり彼らの間違いを証明していますが、彼らはどうにかしてそれを勝利とみなしています」というものです。ファリーナは、2005年のキッツミラー対ドーバー裁判でのベーエの専門家証言に言及しています。
2004年の論文について質問されたとき、ベーエは、彼らのモデルの集団サイズが現実の細菌集団よりも桁違いに小さいことを暗黙のうちに認めましたが、このことは、そのような「還元不能な」形質が進化する速度を大幅に過小評価する効果がありました。・・・ある印象的なやりとりの中で、ベーエは、1トンの土壌には彼のモデル集団よりも多くの原核生物が存在することを示唆する論文を認めましたが、地球上には1トンよりも多くの土壌が存在します。
しかし、この反論はファリーナが論文を誤読したことに起因しています。まさにファリーナが引用している裁判記録でベーエ自身が説明しているように、「新しいジスルフィド結合を形成するのに要求されるのは、わずか2つの点突然変異かもしれません。しかし、タンパク質-タンパク質結合部位のような他の複数残基の特徴を形成するには、もっと多くの変異が要求されるかもしれません」。下のグラフ (論文の図6) は、ベーエとスノークの推定した固定までの時間 (y軸) と、新しい特徴が進化するのに必要な置換の数 (x軸) を示しています。上軸には必要な集団サイズの値が示されています。要点は、必要な共依存性突然変異の数が増加するにつれて、必要な集団サイズと固定までの待ち時間も増加するということです。
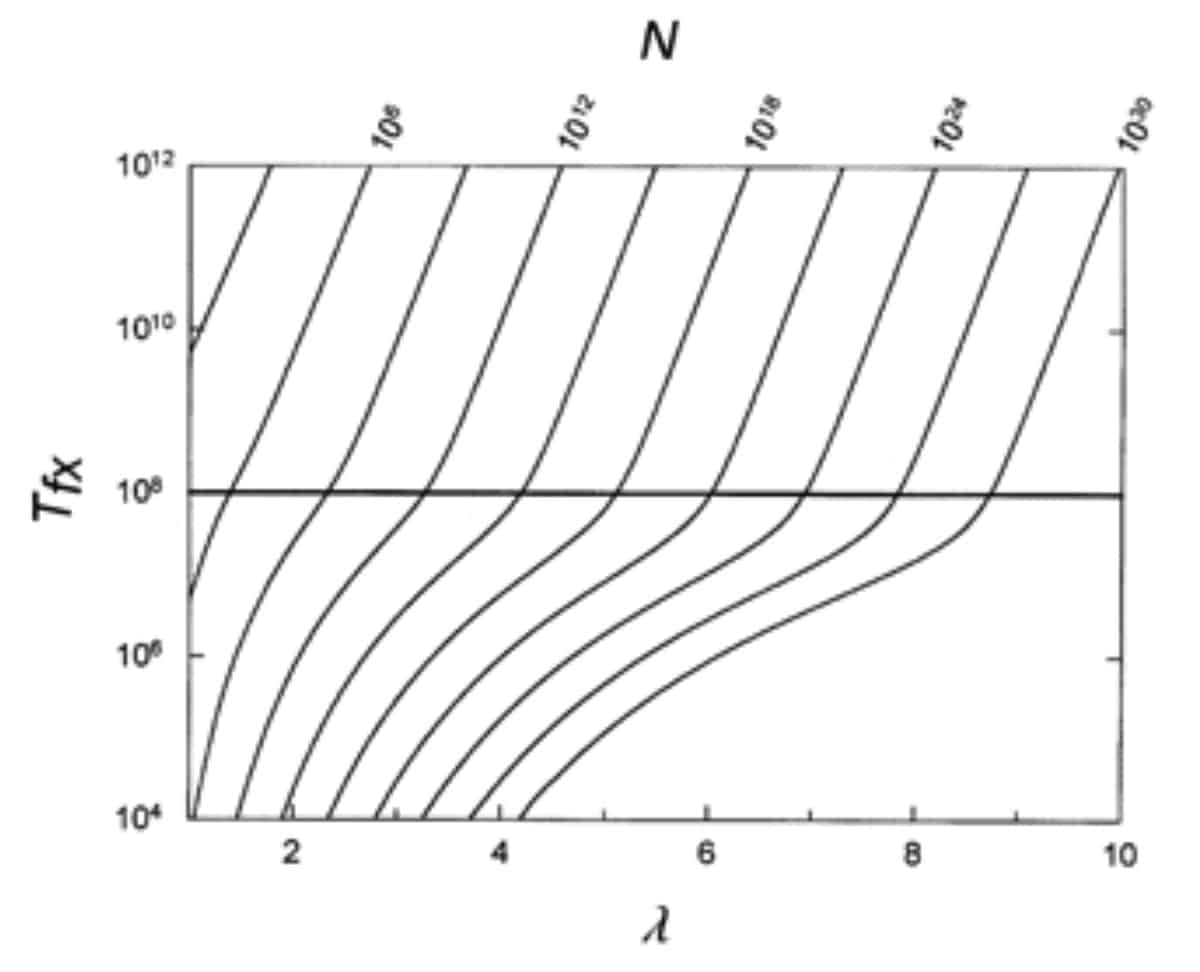
論文の中でベーエとスノークが説明しているように、ある新規の特徴が生じるのに3つの置換が要求されるシナリオでは、それが108世代かけて固定化されるのに必要な集団サイズはおよそ1011個体です (図で横棒で示されているのが108世代です)。問題となっている複雑な形質がさらに多くの置換を必要とする場合、それにはかなりの、より多くの時間が要求されます。もし6つの突然変異が必要だとすると、108世代で固定されるのに必要な平均集団サイズは1022個体というオーダーになります。全地球上の微生物の数の妥当な推定値が1030個である9ことを考えると、これらの数が法外な値となることはすぐに理解できます。
2番目の不平は、「彼らのモデルでは、ベーエとスノークは単一塩基の突然変異と自然選択のみを許容しています。組換えも、最初に仮定されたものを超える重複も、他の進化的変化も許容していません」というものです。しかし著者たちは、「ここで提示したモデルには組換えが含まれていないため、この結果は単相の無性集団に最も当てはまると考えられる」と明白に述べています。それにもかかわらず、彼らは論文の結論でまさしく、「この結果は複相の有性生物の進化にも影響を与える」と述べています。というのも、大型の多細胞生物は、細菌よりもずっと、はるかに集団サイズが小さいからです。もし複雑な特徴の進化が (大規模な集団サイズと短い世代交代時間をもってしても) 微生物にとって難しいのであれば、大型動物にとってはなおさらでしょう。複相の有性種の場合、組換えによって中立突然変異が集団の中で別々に起こり、後に有性生殖の組換えによって結びつくことができると反論する人もいるかもしれませんが、クリスチャンセン他は『Theoretical Population Biology』に掲載されたある論文で、「組換えは新しい遺伝子型の組み合わせが最初に現れるまでの待ち時間を短くするが、その効果は突然変異率や集団サイズに比べれば小さい」(強調追加) ことを示しました10。
最後にファリーナは、「彼らはまた、あらかじめ決められた標的配列を特定し、その特定の標的が進化した場合のみ、シミュレーションが『成功した』と考えました」と不平を述べています。しかし、これは不正確です。むしろこの論文は、複数の共依存性突然変異 (どれもそれ自体では有利性をもたらさない) が集団内で固定化されるまでに、どれだけの数の生物が、どれだけの時間枠で要求されるかの見積もりを提供しているのです。
次回は、ベーエ博士の『The Edge of Evolution』へのファリーナの批判に回答します。
注釈
- Minamino, T., Imada, K., & Namba, K. (2008) Molecular motors of the bacterial flagella. Current Opinion in Structural Biology. 18 (6), 693-701.
- Johnson, S., Furlong, E. J., Deme, J. C., Nord, A. L., Caesar, J. J. E., Chevance, F. F. V., Berry, R. M., Hughes, K. T., & Lea, S. M. (2021) Molecular structure of the intact bacterial flagellar basal body. Nature Microbiology. 6 (6), 712-721.
- Kitao, A. & Hata, H. (2018) Molecular dynamics simulation of bacterial flagella. Biophysical Reviews. 10 (2), 617-629.
- Yamaguchi, T., Makino, F., Miyata, T., Minamino, T., Kato, T., & Namba, K. (2021) Structure of the molecular bushing of the bacterial flagellar motor. Nature Communications. 12 (1), 4469-4469.
- Blair, K. M., Turner, L., Winkelman, J. T., Berg, H. C., & Kearns, D. B. (2008) A molecular clutch disables flagella in the Bacillus subtilis biofilm. Science (New York, N.Y.). 320 (5883), 1636-1638.
- Sowa, Y. & Berry, R. M. (2008) Bacterial flagellar motor. Quarterly Reviews of Biophysics. 41 (2), 103-132.
- Taylor, T. B., Mulley, G., Dills, A. H., Alsohim, A. S., McGuffin, L. J., Studholme, D. J., Silby, M. W., Brockhurst, M. A., Johnson, L. J., & Jackson, R. W. (2015) Evolution. Evolutionary resurrection of flagellar motility via rewiring of the nitrogen regulation system. Science (American Association for the Advancement of Science). 347 (6225), 1014-1017.
- Behe, M. J. & Snoke, D. W. (2004) Simulating evolution by gene duplication of protein features that require multiple amino acid residues. Protein Science. 13 (10), 2651-2664.
- Whitman, W. B., Coleman, D. C., & Wiebe, W. J. (1998) Prokaryotes; the unseen majority. Proceedings of the National Academy of Sciences - PNAS. 95 (12), 6578-6583.
- Christiansen, F. B., Otto, S. P., Bergman, A., & Feldman, M. W. (1998) Waiting with and without Recombination: The Time to Production of a Double Mutant. Theoretical Population Biology. 53 (3), 199-215.